Acyl-Carrier-Proteine (ACP) sind eine Gruppe von Proteinen, die Bestandteil der Fettsäure-Synthase und der Polyketid-Synthase sind. Es ist außerdem eines der am meisten vorkommenden Proteine in E. coli. In beiden Fällen ist die wachsende Kette über Thioester der Thiolgruppe des 4′-Phosphopantethein-Restes an das ACP gebunden.
Struktur
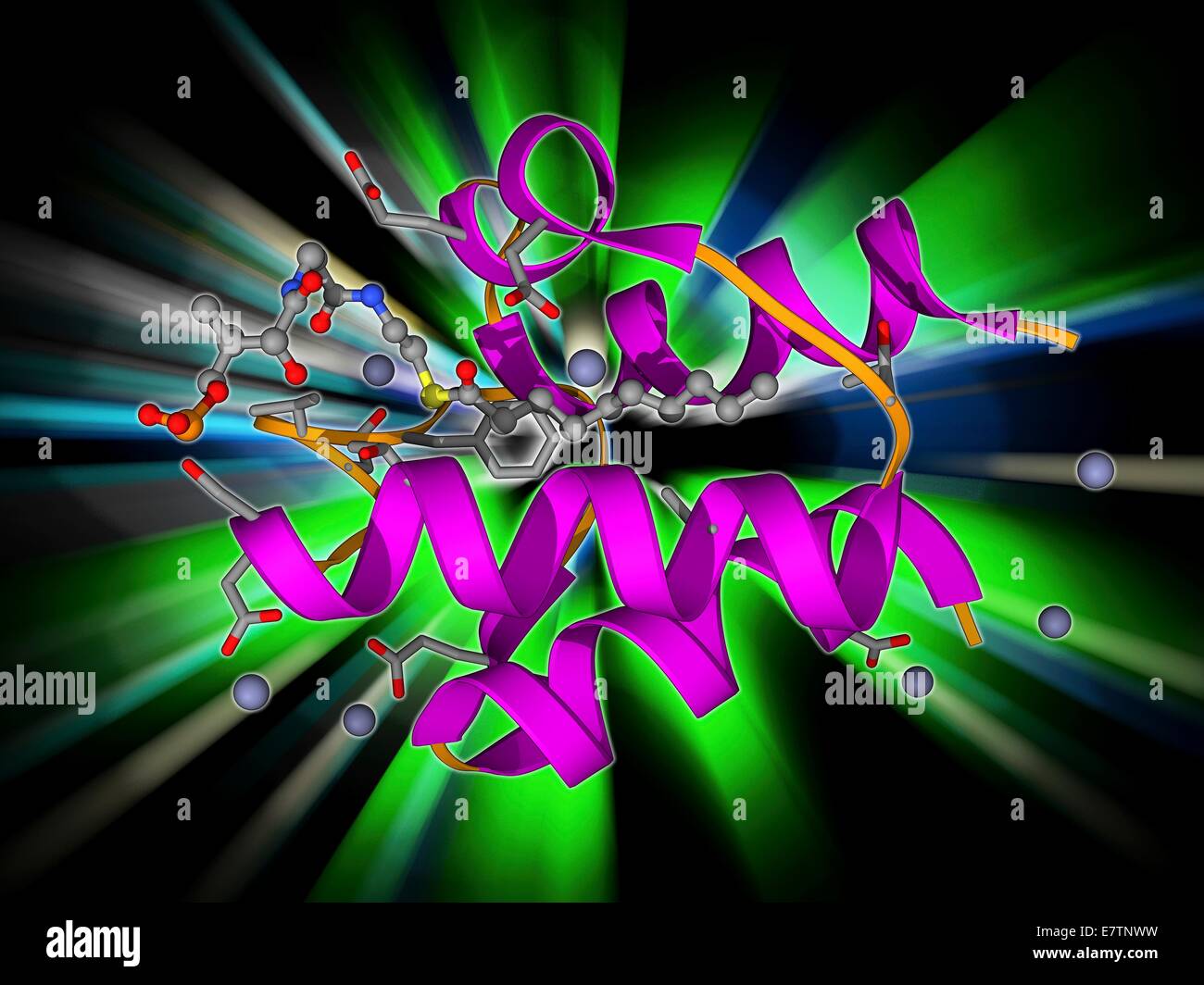
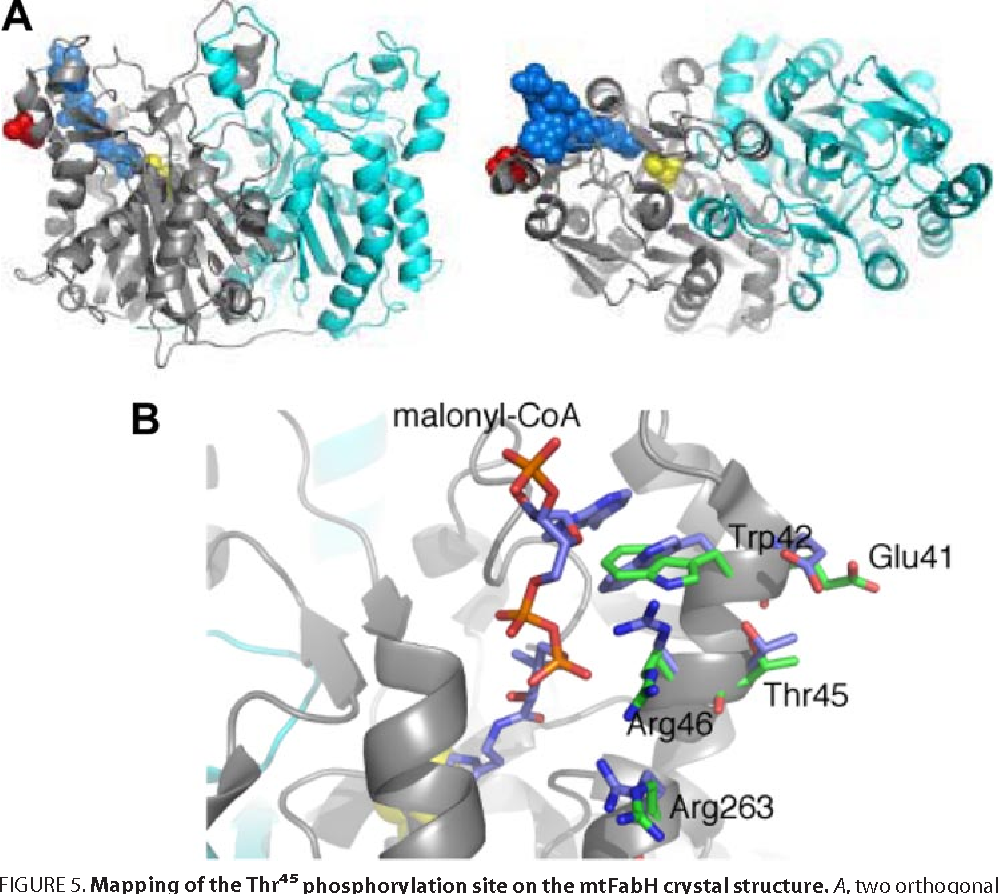
ACPs sind eine homogene Gruppe von kleinen negativ geladenen Proteinen, die aus α-Helix-Bündeln bestehen sowie hohe Ähnlichkeit in Struktur und Aminosäuresequenz aufweisen. Die Strukturaufklärung fand via verschiedener Kernspinresonanzspektroskopie- und Kristallographie-Verfahren statt. Strukturell und mechanistisch ähneln sie den Peptidyl-Carrier-Proteinen (PCP) von nichtribosomalen Peptid-Synthasen.
Biosynthese
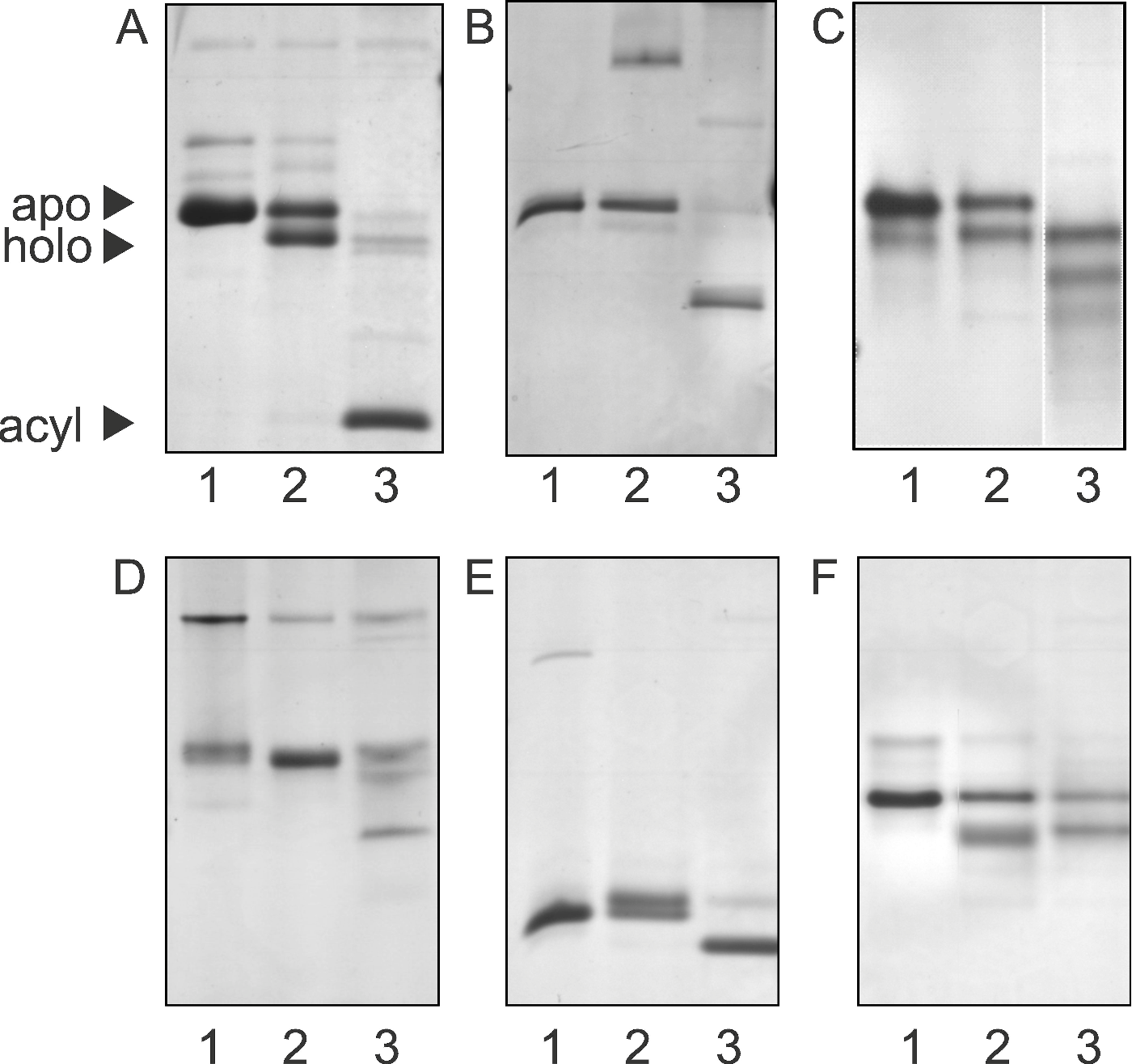
Nach der Expression des inaktiven apo ACPs wird der 4'-Phosphopantethein-Rest an einen Serinrest geknüpft. Diese Verknüpfung wird von der Acyl-Carrier-Protein-Synthase (ACPS), einer 4'-Phosphopantetheinyl-Transferase, katalysiert. 4'-Phosphopantethein ist eine prosthetische Gruppe von mehreren ACPs inklusive des ACPs der Fettsäure-Synthase, der Polyketid-Synthase, des Peptidyl-Carrier-Proteins und der Aryl-Carrier-Proteine der nichtribosomalen Peptid-Synthasen (NRPS).
Weblinks
- MESH ACP
Einzelnachweise